Tumortherapie: Neue Ansätze, um Krebs zu stoppen
Krebs zählt zu den häufigsten Todesursachen in Deutschland und in der westlichen Welt. Die zielgerichtete Tumor-Diagnostik und -Therapie ist für die Patienten von großer Bedeutung und Gegenstand aktueller Forschungsprojekte. Im Rahmen einer Studie eines internationalen Forscherteams aus Deutschland, Dänemark und England haben die Wissenschaftlerinnen und Wissenschaftler einen neuen Hebel identifiziert, den sie ansetzen können, um Tumore zu bekämpfen. An dem Projekt waren auch Prof. Dr. Christian Reinhardt, der eine Lichtenberg-Professur an der Uniklinik Köln im Exzellenzcluster CECAD inne hat, sowie seine Mitarbeiter beteiligt: "Die neuen Erkenntnisse bieten einen neuartigen molekularen Ansatzpunkt, um genetisch definierte Tumore in der Zukunft effektiver zu behandeln." Die Studie ist am 2. Juli 2015 im renommierten Fachjournal Cell erschienen. Sie besagt, dass die Forscher zwei Enzyme (Chk1 und MK2) identifiziert haben, die für das Tumorwachstum, also die Vermehrung von Tumorzellen, essenziell sind. Enzyme können in menschlichen Zellen als Katalysatoren eine chemische Reaktion beschleunigen können. Chk1 und MK2 sind entscheidend für die Zellteilung, wenn in den Tumorzellen oder Tumoren eine Mutation des sogenannten KRAS Gens vorliegt.

Diese Mutation ist eine der am häufigsten vorliegenden Mutationen in menschlichen Tumoren und bei fast allen Krebserkrankungen der Bauchspeicheldrüse sowie in rund einem Drittel aller Bronchial- und Dickdarmtumore vorhanden. Sie führt zu einem massiv gesteigerten Zellwachstum, was allerdings zu Komplikationen führt: Die Verdopplung der DNA, die Tumorzellen vor jeder Zellteilung durchführen müssen, ist unter den beschleunigten Wachstumsbedingungen nur erschwert möglich. Wie die Kölner Forscher herausgefunden haben, sind die Tumorzellen für die fehlerfreie Verdopplung ihrer DNA auf die Funktion der Enzyme MK2 und Chk1 angewiesen. Gesundes Gewebe benötigt hingegen die Funktion der beiden Enzyme weitestgehend nicht.
Neue Therapien lassen sich entwickeln
An diesem Unterschied zwischen Tumorzellen und normalen Zellen können neue Therapiemöglichkeiten für Krebserkrankungen ansetzen. Denn die Wissenschaftler konnten durch ein Screening-Verfahren mit verschiedenen Substanzen zeigen, dass Tumorzellen und Tumore mit KRAS Mutationen sehr gut auf eine Kombinationstherapie mit Chk1- und MK2-Hemmstoffen ansprechen. Das normale Gewebe toleriert die Kombinationstherapie ohne entscheidende Nebenwirkungen. "Diese Chk1/MK2 Hemmung kann speziell gegen KRAS-mutierte Krebszellen wirken, während normales Gewebe geschont bleibt, da in den gesunden Zellen das KRAS Gen nicht mutiert ist", fasst Dr. Felix Dietlein, Erstautor der Publikation, zusammen.
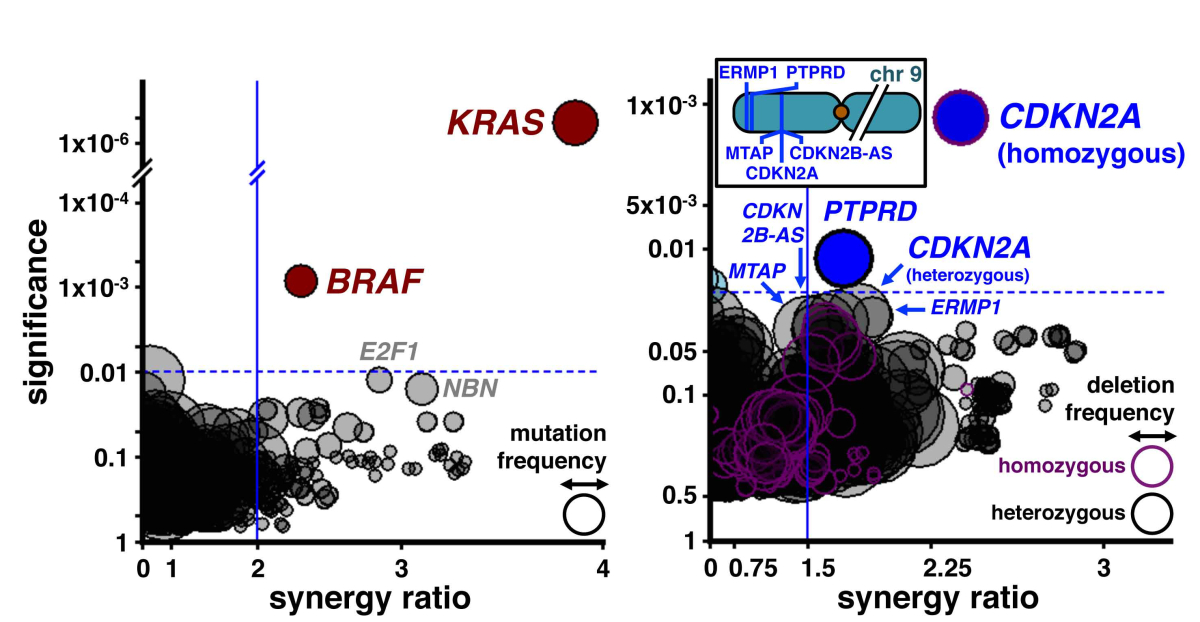
Einen weiteren Faktor für die Bedeutung dieser Forschung führt Prof. Dr. Michael Hallek, Leiter der Klinik I für Innere Medizin an der Uniklinik Köln, an: "MK2 ist ein Enzym, das schon seit längerer Zeit genau untersucht wird, denn die Funktion dieses Proteins scheint ebenfalls eine Rolle bei der Entwicklung rheumatischer Erkrankungen zu spielen. Auch Chk1 wurde in den letzten Jahren intensiv betrachtet und es finden aktuell bereits erste klinische Untersuchungen mit verschiedenen Chk1 Inhibitoren statt. Diese faszinierenden neuen Daten geben den behandelnden Ärzten in naher Zukunft möglicherweise ein Werkzeug an die Hand, mit dessen Hilfe KRAS-mutierte Tumore effektiv behandelt werden können." Aktuell liegt noch keine Zulassung der MK2 Hemmer vor, Forschungen zur Entwicklung solcher Medikamente laufen aber bereits seit einiger Zeit. Die Arbeiten an dem aktuellen Projekt haben die Deutsche Forschungsgemeinschaft, die Deutsche Krebshilfe und die VolkswagenStiftung maßgeblich gefördert.
Informationen zur Publikation
Felix Dietlein, Bastian Kalb, Mladen Jokic, Elisa M. Noll, Alexander Strong, Lars Tharun, Luka Ozretić, Helen Künstlinger, Kato Kambartel, Winfried J. Randerath, Christian Jüngst, Anna Schmitt, Alessandro Torgovnick, André Richters, Daniel Rauh, Florian Siedek, Thorsten Persigehl, Cornelia Mauch, Jirina Bartkova, Allan Bradley, Martin R. Sprick, Andreas Trumpp, Roland Rad, Dieter Saur, Jiri Bartek, Jürgen Wolf, Reinhard Büttner, Roman K. Thomas, H. Christian Reinhardt. 2015. A Synergistic Interaction between Chk1- and MK2 Inhibitors in KRAS-Mutant Cancer Cell, Volume 162, Issue 1, 2 July 2015, Pages 146–159 Link zur Publikation im Fachmagazin Cell.
Hintergrund: Die Lichtenberg-Professuren der VolkswagenStiftung
Mit den "Lichtenberg-Professuren" kombiniert die VolkswagenStiftung die personen- und institutionsbezogene Förderung: Indem herausragende (Nachwuchs-)Wissenschaftler(innen) eine Tenure-Track-Option an einer selbst gewählten deutschen Universität erhalten, bekommen sie die Möglichkeit, eigenständig und langfristig in innovativen und interdisziplinären Bereichen zu forschen.

